齊魯製藥公佈艾帕洛利托沃瑞利單抗聯合化療宮頸癌研究最新結果

 |
濟南2023年10月26日 /美通社/ — 10月22日,在2023年歐洲腫瘤內科學會(ESMO)年會上,齊魯製藥公佈了艾帕洛利托沃瑞利單抗(QL1706)聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌(r/mCC)的多中心、單臂II期臨床研究最新研究結果,報告人為遼寧省腫瘤醫院王丹波教授。
艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療復發/轉移性宮頸癌顯示出良好的客觀緩解率和生存獲益,安全性可控且未觀察到新的安全信號,有望成為復發/轉移性宮頸癌一線治療的新選擇。
一、研究背景
目前r/mCC的標準一線治療優選方案為順鉑或卡鉑聯合紫杉醇加貝伐珠單抗,同時要考慮療效和安全性;對PD-L1表達陽性的r/mCC患者,推薦採用PD-1抑制劑帕博利珠單抗聯合化療加或不加貝伐珠單抗作為一線標準治療。[1-2] 免疫聯合化療已成為復發/轉移性宮頸癌的標準治療。根據KEYNOTE-826研究最新結果,聯合帕博利珠單抗後,免疫聯合化療加或不加貝伐珠單抗一線治療PD-L1陽性(CPS≥1)r/mCC的中位無進展生存期(PFS)從8.2個月延長到10.4個月,中位總生存期(OS)從16.5個月延長到28.6個月。[3-4] 儘管PD-1抑制劑聯合化療與化療相比顯著改善了患者生存,患者的生存獲益仍然較有限,存在未滿足的臨床需求。
二、研究設計
本次研究納入未接受過系統治療的復發或轉移性宮頸癌患者,分別接受艾帕洛利托沃瑞利單抗聯合化療(隊列1)或再聯合貝伐珠單抗(隊列2)治療,直至疾病進展、出現不可耐受的毒性,或患者撤回知情同意。研究的主要終點為安全性,次要終點包括研究者根據實體瘤反應評價標準(RECIST)v1.1評估的ORR、緩解持續時間(DOR)、疾病控制率(DCR)和PFS,以及OS。研究設計如圖1所示。
圖1:艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌臨床研究設計
三、研究結果
研究共入組60例患者,隊列1和隊列2各30例,分別接受艾帕洛利托沃瑞利單抗聯合順鉑/卡鉑加紫杉醇或再加貝伐珠單抗治療。所有患者的平均年齡為52.0歲,58.3%的患者ECOG行為學評分為1;78.3%的患者的病理類型為鱗癌,86.7%的患者為復發性宮頸癌。
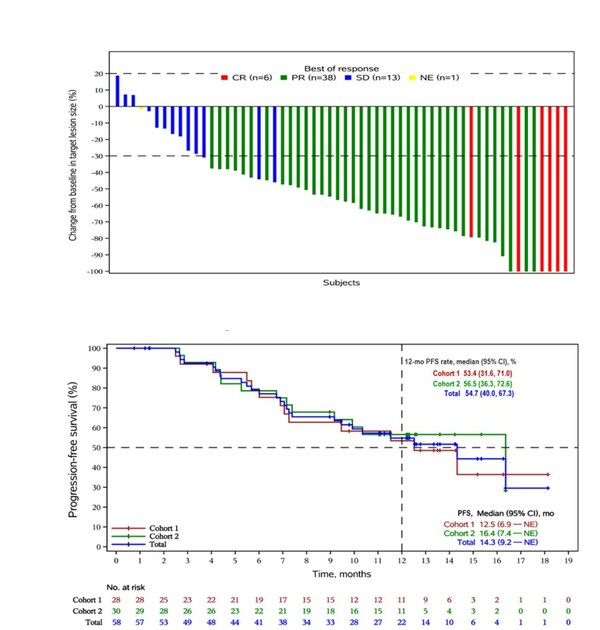
截至2023年4月24日,中位隨訪時間為14.0個月,共有58例患者至少接受1次基線後療效評估,客觀緩解率ORR為81.0% (95% CI, 68.6–90.1),其中有8例患者達到完全緩解(CR),39例患者達到部分緩解(PR);DCR為98.3% (95% CI,90.8–100.0)。中位PFS達到14.3個月(95% CI,9.2個月–不可評估),中位OS未達到。聯合貝伐珠單抗隊列2的中位PFS達到16.4個月。(圖2)
在安全性方面,所有患者發生治療相關不良事件(TRAEs),其中3級及以上不良事件的發生率為71.7%;最常見的TRAEs為白細胞計數減少 (71.3%)、中性粒細胞計數減少(68.3%)和貧血(43.3%)。治療相關嚴重不良事件的發生率為30%;免疫相關不良事件(irAEs)的發生率為13.3%;導致治療停止的TRAEs的發生率為26.7%;治療相關死亡的發生率為1.7%(可能為貝伐珠單抗相關)。(圖3)
三、小結
本研究結果顯示,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療r/mCC具有良好的療效和安全性,且不區分PD-L1表達水平,患者均顯示獲益。
基於此項研究結果,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗治療持續性、復發性或轉移性宮頸癌的III期臨床研究正在進行中。艾帕洛利托沃瑞利單抗用於治療經過至少一線含鉑標準治療失敗的復發性或轉移性的宮頸癌患者的新藥上市申請已於今年8月獲得CDE受理。
參考文獻:
1.中國臨床腫瘤學會指南工作委員會. 宮頸癌診療指南[M]. 2023. 北京:人民衛生出版社, 2023:70.
2.Tewari KS, et al. Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med. 2014 Feb 20;370(8):734-43. doi: 10.1056/NEJMoa1309748. Erratum in: N Engl J Med. 2017 17;377(7):702.
3.Colombo N, et al. Pembrolizumab for Persistent, Recurrent, or Metastatic Cervical Cancer. N Engl J Med. 2021 11;385(20):1856-1867.
4.J Clin Oncol 41, 2023 (suppl 16; abstr 5500) .